近年来多篇MAMs的文章登上了一区,详细介绍了MAMs的结构、功能等,并强调了它在相关疾病发病机制中的作用。
· 这篇文章证实了 Mfn2 调节 MAM 和线粒体的形态和功能,并通过抑制PERK通路对足细胞发挥抗凋亡作用。因此,Mfn2-PERK信号通路可能是预防DKD足细胞损伤的新治疗靶点。

· 下面这篇文章则总结了MAMs相关蛋白质对疾病的潜在影响,涉及多种疾病的生理病理学。

· 通过探讨MAMs在AD病理调控中的作用,以及与MAM介导的AD病理变化相关的潜在分子机制,加强对AD临床前发病机制的认识可以提供新的治疗策略,将方式从治疗转变为预防。

那么,MAMs究竟是什么呢?
01 MAMs简介
内质网作为细胞中的关键结构,其在钙储存、脂质合成、蛋白质折叠及装配等过程中发挥了不可替代的作用[1];而线粒体则被誉为细胞的"动力工厂",为多种细胞生理活动提供能量支持[2],同时在细胞凋亡过程中也起到决定性作用。
为确保内质网与线粒体间功能协调,两者依赖于线粒体相关内质网膜(MAM)进行精确联系,即两个细胞器的直接接触位置。20世纪50年代后期,电子显微镜首先在大鼠肝脏组织中发现了内质网-线粒体并列现象;但由于固定处理,这一现象曾被误认为是伪影[3]。然而,时至今日,通过运用实时成像技术、新式电子显微镜方法以及亚细胞层面的分离分析,MAM的存在得到了可信证实[4]。
02 MAMs功能
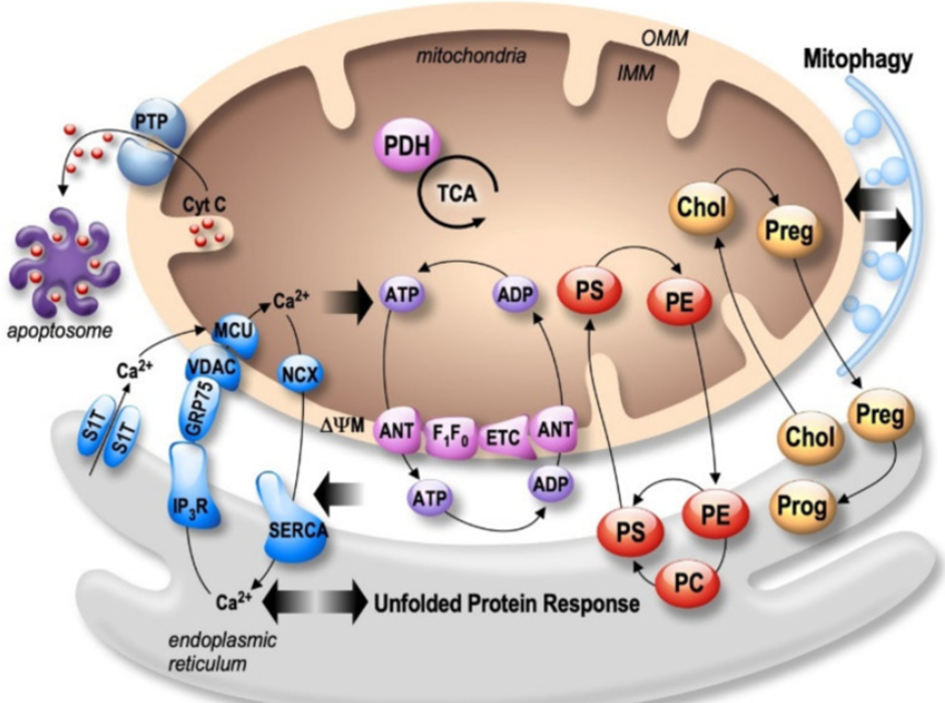
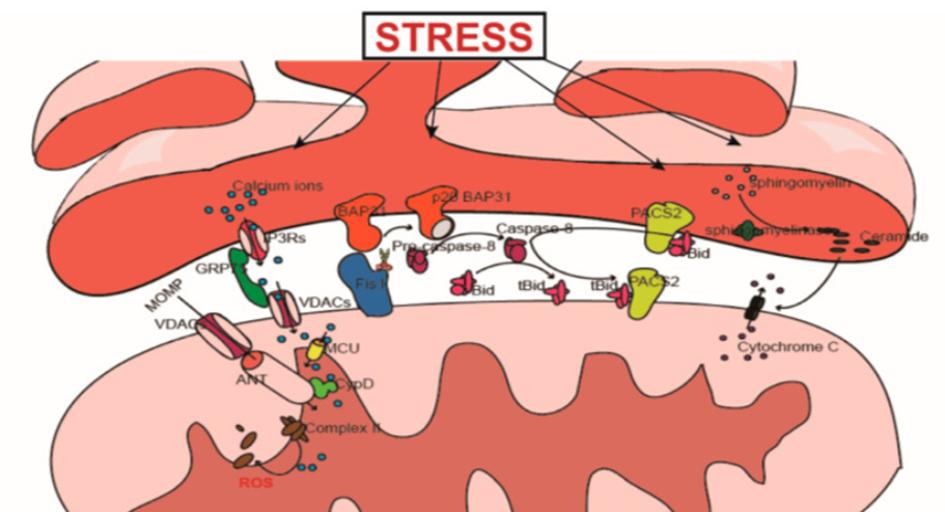
此类接触点具备特定构造,代表多个细胞内功能的核心阶段。实际上,内质网-线粒体的相互作用是众多细胞过程如钙离子稳态、脂质转运、线粒体活动、细胞凋亡以及线粒体自我消化等环节的关键因素。
2.1脂质合成和转移
MAM 含有多类参与脂质代谢的蛋白质,如磷脂酰丝氨酸合酶 (PSS)、脂肪酸辅酶 A 连接酶 4 (FACL4)、磷脂酰乙醇胺 N-甲基转移酶 2 (PEMT2)、磷脂酰丝氨酸脱羧酶 (PSD) 及磷脂、三酰基甘油合成与类固醇生成等功能蛋白质。小窝蛋白-1 (CAV-1) 为 MAM 的重要组成部分,可助推脂质与胆固醇代谢[5]。
2.2线粒体动力学
线粒体动力学涉及裂变及融合,对维持细胞稳态至关重要。参与该过程的蛋白主要位于MAM区域。MFN1和MFN2调控OMM融合,另一方面,视萎缩蛋白1(OPA1)控制IMM融合。线粒体裂变过程受动力蛋白相关蛋白1(Drp1)、Fis1、线粒体裂变因子(Mff)以及49和51kDa线粒体动态蛋白(MiD49/51)调控。近期一项研究称,MAM为线粒体裂变的初始场所[6]。
2.3自噬和细胞凋亡
众多自噬蛋白分布于MAM区,其自噬包膜起源亦或源自有MAM[7]。在饥饿环境下,前自噬体标记物自噬相关14样(ATG14L)作用于雷帕霉素复合体2(mTORC2),令后者产生自噬诱导因子,将哺乳动物靶标重新定向至MAM,从而激发出自噬体的形成过程。根据现有的研究,MAMs拴系复合体的减少有可能引发大鼠海马自噬功能失调[6]。此外,MAMs透过BAP31-Fis1拴系复合体招募procaspase-8,促使Ca2+从内质网中释出,进而诱发细胞凋亡[8]。
03 MAMs与疾病
众多研究数据揭示,内质网-线粒体间的通信失衡可能影响糖尿病、癌症和如阿尔茨海默病(AD)、帕金森病(PD)及肌萎缩侧索硬化症(ALS)等神经退行性疾病的病因。
3.1心力衰竭
FUNDC1 在 MAMs中的降低使 SR Ca2+受损,通过抑制 IP3R2 泛素依赖性降解转移至线粒体,从而干扰CREB/Fis1 通路并最终对心脏功能构成损害。另一方面,FUNDC1 敲除小鼠展现出舒张和收缩功能障碍[9]。反之,FUNDC1 的过表达会提升心肌细胞胞质及线粒体 Ca2+水平,降低 SR Ca2+水平。
Sig-1R与结合免疫球蛋白(BiP)和延长的线粒体 Ca2+解离,在内质网应激下通过IP3R吸收[10]。Sig-1R负责调节Ca2+进入线粒体,从而促进ATP生成[11]。Sig-1R敲除小鼠则显示出线粒体功能障碍和心脏结构重组,引发心功能异常。此外,氟伏沙明含有高亲和力的Sig-1R,为接受 TAC 的小鼠和大鼠模型的心力衰竭提供了缓解效果[12]。
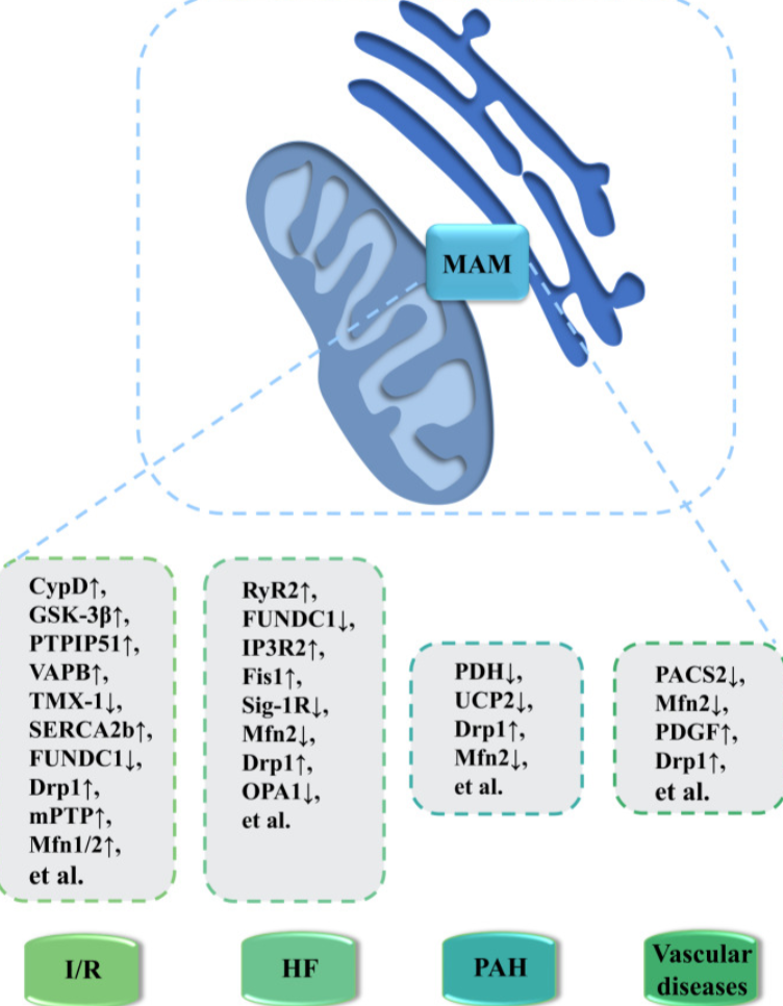
3.2 DKD损伤
衣霉素诱导的内质网应激可增加肝肌肉区MAM的数量[13],然而其对内质网应激的挽救作用具有时间依赖性。具体来说,在早期内质网应激阶段,短暂的MAM增加推动Ca2+由内质网向线粒体基质流动,进而提高线粒体生物能量学和ATP含量。ATP充足的环境下,内质网能够更有效地清除错误折叠蛋白。然而,长期过度形成的MAMs会导致线粒体基质内Ca2+浓度的缓慢持续上升,进而引发肥胖病情下肝细胞线粒体功能障碍[13]。
3.3 AD
Aβ可通过OMM转位酶输入线粒体并定位嵴膜[14]。γ-分泌酶除在质膜定位外,还存在于各种亚细胞区室,尤其以MAM为主[15]。Aβ40及Aβ42分别在MAM及线粒体附近产生[15]。这些研究揭示了AD患者中Aβ如何在线粒体中聚集:MAM参与Aβ的细胞内产生过程,OMM则将其转运至线粒体。MAM的增多或许会加强线粒体Aβ的沉积并增加它与线粒体蛋白的交互作用。
04国自然热点分析
随着内质网应激、线粒体自噬等创新点的大火,让我们更加深入探究细胞功能的异质性。我们可以在此二者的基础上检测些MAMs的特异性蛋白,为后续基础研究或者国自然立项假说的探索提供一定的方向选择。
近年来,部分和线粒体研究热点相关的国自然立项如下,供大家参考:

目前,MAMs在国自然立项的项目并不是很多。就从上述来看,MAMs可以结合细胞死亡、中医、代谢、炎症等相关的前期背景,应该是不少人比较好的国自然选择方向。下面是一些研究思路:
1. 基础研究方面:可通过深入研究MAMs如何调控线粒体与内质网的功能;也可深入探索MAMs中存在的蛋白与疾病之间的关系;或可从时空角度探索MAMs对线粒体与内质网的调控;
2. 转化研究:研究MAMs的关键蛋白,开发新型药物;或利用新技术如人工智能等挖掘更多潜在靶点;亦可将MAMs的蛋白加入临床疗效评估。
参考文献
1. Schwarz, D.S.; Blower, M.D. The endoplasmic reticulum: Structure, function and response to cellular signaling.Cell. Mol. Life Sci. 2016, 73, 79–94.
2.Annesley, S.J.; Fisher, P.R. Mitochondria in Health and Disease. Cells 2019, 8, 680.
3. Doghman-Bouguerra, M.; Lalli, E. ER-mitochondria interactions: Both strength and weakness within cancer cells.Biochim. Biophys. Acta Mol. Cell Res. 2019, 1866, 650–662.
4. Mannella, C.A. The relevance of mitochondrial membrane topology to mitochondrial function.Biochim. Biophys. Acta 2006, 1762, 140–147.
5. Sala-Vila A, Navarro-Lérida I, Sánchez-Alvarez M, Bosch M, Calvo C, López J, et al. Interplay between hepatic mitochondria-associated membranes, lipid metabolism and caveolin-1 in mice. Sci Rep. (2016) 6:27351.
6. Friedman J, Lackner L, West M, DiBenedetto J, Nunnari J, Voeltz G. Er tubules mark sites of mitochondrial division. Science. (2011) 334:358–62.
7. Hamasaki M, Furuta N, Matsuda A, Nezu A, Yamamoto A, Fujita N, et al. Autophagosomes form at Er-mitochondria contact sites. Nature. (2013) 495:389–93.
8. Iwasawa R, Mahul-Mellier A, Datler C, Pazarentzos E, Grimm S. Fis1 and Bap31 bridge the Mitochondria-Er Interface to establish a platform for apoptosis induction.Embo J. (2011) 30:556–68.
9. Wu S, Lu Q, Wang Q, Ding Y, Ma Z, Mao X, et al. Binding of Fun14 Domain Containing 1 with Inositol 1,4,5-Trisphosphate receptor in mitochondria-associated endoplasmic reticulum membranes maintains mitochondrial dynamics and function in heartsin Vivo. Circulation. (2017) 136:2248–66.
10. Hayashi T, Su T. Sigma-1 receptor chaperones at the Er-Mitochondrion Interface Regulate Ca(2+) Signaling and Cell Survival. Cell. (2007) 131:596–610.
11. Abdullah C, Alam S, Aishwarya R, Miriyala S, Panchatcharam M, Bhuiyan M, et al. Cardiac dysfunction in the sigma 1 receptor knockout mouse associated with impaired mitochondrial dynamics and bioenergetics. J Am Heart Assoc. (2018) 7:e009775.
12. Orlando R, De Martin S, Andrighetto L, Floreani M, Palatini P. Fluvoxamine pharmacokinetics in healthy elderly subjects and elderly patients with chronic heart failure. Br J Clin Pharmacol. (2010) 69:279–86.
13. P. Arruda, B. M. Pers, G. Parlakgül, E. Güney, K. Inouye, and G. S. Hotamisligil, “Chronic enrichment of hepatic endoplasmic reticulum-mitochondria contact leads to mitochondrial dysfunction in obesity,” Nature Medicine, vol. 20, no. 12, pp. 1427–1435, 2014.
14. Hansson Petersen CA, Alikhani N, Behbahani H, Wiehager B, Pavlov PF, Alafuzoff I, Leinonen V, Ito A, Winblad B, Glaser E, Ankarcrona M. The amyloid beta-peptide is imported into mitochondria via the TOM import machinery and localized to mitochondrial cristae. Proc Natl Acad Sci U S A. 2008 Sep 2;105(35):13145-50.
15. Schreiner B, Hedskog L, Wiehager B, Ankarcrona M. Amyloid-β peptides are generated in mitochondria-associated endoplasmic reticulum membranes. J Alzheimers Dis. 2015;43(2):369-74.













